參考FDA的SC上市審批路徑,2017年下半年起,同品種比對臨床評價在我國醫療器械上市審批也更廣泛認可,越來越多針對具體產品的同品種比對臨床評價指導文件出臺。
髖關節假體同品種臨床評價技術審評要點
本審評要點旨在指導注冊申請人對髖關節假體產品注冊申報資料的準備及撰寫,同時也為技術審評部門審評注冊申報資料提供參考。
本審評要點是對髖關節假體產品的臨床評價要求,注冊申請人應依據產品的具體特性確定其中內容是否適用,若不適用,需具體闡述理由及相應的科學依據,并依據產品的具體特性對注冊申報資料的內容進行充實和細化。
一、適用范圍
本審評要點適用于常規設計的髖關節假體同品種臨床評價,按現行《醫療器械分類目錄》,該類產品分類編碼為13-04-01,管理類別為III類。。常規設計的髖關節假體通常由髖臼杯、髖臼內襯、股骨球頭、股骨柄組成,具體包括:
由符合GB/T19701標準的普通超高分子量聚乙烯、符合YYT0811標準的高交聯超高分子量聚乙烯或符合YY/T 1294標準的陶瓷材料制成的髖臼內襯;由符合YY/T0117.3標準的鑄造鈷鉻鉬、符合YY/T0605-12標準的鍛造鈷鉻鉬或符合GB/T13810標準的TC4和TC4ELI合金制成的髖臼杯組件;由分別符合YY/T0605-9標準的高氮不銹鋼、符合YY/T0117.3標準的鑄造鈷鉻鉬、符合YY/T0605-12標準的鍛造鈷鉻鉬或符合GB/T13810標準的TC4、TC4ELI和TC20制成的股骨柄組件;由符合YY/T0605-9標準的高氮不銹鋼、符合YY/T0117.3標準的鑄造鈷鉻鉬、符合YY/T0605-12標準的鍛造鈷鉻鉬或符合YY/T 1294標準的陶瓷材料制成的股骨頭,由純鈦或鈣磷陶瓷制成的涂層。不包括新材料、特殊設計的髖關節假體和定制髖關節假體等。
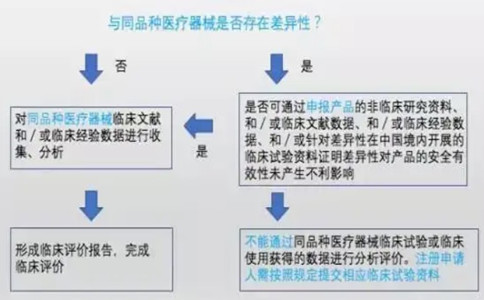
與境內已上市產品相比,申報產品如具有全新的技術特性(如采用了全新的工作原理、技術、材質、結構設計、表面處理、手術方式等),或具有全新的臨床適用范圍,已有數據無法證明擬申報產品安全有效的,可考慮通過臨床試驗來獲得臨床數據。
二、同品種臨床評價的基本要求
(一)同品種醫療器械的選擇
注冊申請人通過同品種比對方式開展髖關節假體的臨床評價時,可選用一個或多個同品種醫療器械進行比對,宜優先選擇與申報產品適用范圍相同、技術特征相同或盡可能相似的產品作為同品種醫療器械。申報產品與同品種醫療器械技術特征差異越大,論證差異對安全有效性的影響難度越大。例如,材料牌號不同對產品性能影響較大,建議選擇相同牌號材料產品作為同品種醫療器械。
(二)適用范圍及臨床使用相關信息的對比
明確適用范圍以及臨床使用相關信息的相同性和差異性,建議重點考慮以下內容對比(包括但不限于):
1.適應證,如骨性關節炎、類風濕關節炎、創傷性關節炎、股骨頭壞死、股骨頸骨折、先天性髖臼發育不良伴骨關節炎或關節脫位、股骨近端腫瘤需切除股骨頭和股骨頸的情形等;
2.適用人群,如年齡等;
3.疾病的嚴重程度和階段,如適用的骨質條件(如Dorr分型)、先天性髖臼發育不良分級、股骨頭壞死程度等;
4.使用方法,如適用的手術入路等;
5.禁忌證、警告及預防措施
6.其他,如表面置換、全髖/半髖置換、初次/翻修等。
(三)技術特征的對比
申報產品與同品種醫療器械技術特征對比著重關注以下對比內容,包括但不限于:
1.產品組成
注冊申請人需提供申報產品與同品種醫療器械組件信息對比,明確產品的組成部件,以及預期配合的組件信息。
2.產品設計和關鍵尺寸
注冊申請人需提供申報產品與同品種醫療器械結構特征和關鍵尺寸對比,可采用結構圖、關鍵尺寸列表和文字描述等方式,尺寸標注可參考YY/T 0809.1標準。需注意YY/T 0809.1標準僅標注了一般性的結構尺寸,注冊申請人還需結合產品具體設計提供特征結構和關鍵尺寸對比,如涂層區域、髖臼杯和內襯鎖定設計、股骨柄橫截面形狀、裙擺設計等。
3.材料性能
注冊申請人需對比申報產品和同品種醫療器械各組件的材料牌號及材料性能,并論述生產工藝對材料性能的影響。當申報產品和同品種醫療器械的材料牌號相同,且所用材料均符合相應的國家標準、行業標準或國際標準等公認標準,相應標準中規定了材料性能的接受限值時,申報產品的材料性滿足相應標準的要求即可,可不再與同品種醫療器械進行材料性能測試對比,如符合GB/T19701標準要求的超高分子量聚乙烯,符合YY/T0605-9標準的高氮不銹鋼,符合GB/T13810標準的TC4、TC4ELI和TC20,符合YY/T0117.3標準的鑄造鈷鉻鉬和符合YY/T0605-12標準的鍛造鈷鉻鉬等。
對于高交聯超高分子量聚乙烯制成的髖臼內襯,對于壓縮模量、熱性能(結晶度、熔點)、疲勞裂紋擴展、溶脹度、氧化指數、反式亞乙烯指數、自由基濃度、氧化穩定性等材料性能,應開展研究,對研究結果的臨床可接受性應有充分的論證,與同品種醫療器械進行對比有助于評估結果臨床可接受性。若拉伸性能、抗沖擊性能滿足GB/T19701標準要求,上述兩項性能可不再與同品種醫療器械進行測試對比。
4.產品性能
常規設計的髖關節假體產品性能主要包括股骨柄疲勞性能、髖臼杯抗變形性能、關節面磨損性能、涂層性能、髖臼杯與內襯鎖定性能、球頭與股骨柄錐連接性能、髖關節假體活動范圍等。
(1)股骨柄疲勞性能
股骨柄疲勞性能包括頸部和柄部疲勞性能,建議參照YY0118標準提及的方法開展試驗。考慮到相應標準規定了股骨柄疲勞性能的接受限值,申報產品疲勞性能滿足標準要求即可,一般不再要求與同品種醫療器械進行測試對比。
(2)髖臼杯抗變形性能
建議參照YY∕T 0809.12標準開展測試,提供申報產品與同品種醫療器械的測試對比。
若申報產品與注冊申請人境內已上市的髖關節假體產品相比,髖臼杯設計無任何變化,即原材料、結構尺寸、工藝和質控要求完全相同,可提供相應支持性資料,或髖臼杯設計不會改變抗變形性能或會增強抗變形性能,可提供充分的論證,不需與同品種醫療器械進行測試對比。
(3)磨損性能
注冊申請人應提供申報產品髖臼組件與預期配合使用股骨組件形成的關節面的磨損性能資料,并與同品種醫療器械在相同試驗方法下的進行磨損性能對比。進行磨損性能對比時,同品種醫療器械的關節面材料與申報產品需盡可能相同;若存在差異,需闡明同品種醫療器械的選擇依據。推薦采用YY/T 0651、ISO 14242、ISO 17853等標準中的測試方法和參數。磨損性能的對比建議包括磨損率、磨損量-時間曲線、肉眼和顯微鏡下磨損試驗前后關節面形貌等。若為新型關節面材料,還需對磨屑粒徑大小、形貌、生物相容性進行研究。
(4)生物型股骨柄和髖臼杯的涂層性能
生物型股骨柄和髖臼杯常見的涂層材料包括純鈦和鈣磷陶瓷等,常見的涂層工藝包括等離子噴涂、燒結和電泳沉積等。不同涂層材料和工藝形成的涂層微觀結構、力學性能和骨結合性能不同,因此建議盡可能選擇具有相同涂層材料和工藝的產品作為同品種醫療器械。
需對比申報產品與同品種醫療器械的涂層性能和微觀結構。涂層性能包括涂層與基體材料間的力學性能(如拉伸強度、動靜態剪切強度等)和磨損性能。涂層微觀結構主要包括涂層厚度、形貌、粗糙度、孔隙率、平均空隙截距等,具體需對比項目與涂層類型相適應,例如,對于等離子噴涂涂層,應至少包括形貌圖、厚度、孔隙率、平均空隙截距等;對于髖臼杯外表面3D打印多孔結構,微觀結構至少應包括形貌圖、絲徑、最小打印單元結構、孔隙率、孔徑、孔隙漸變梯度、內部連通性等。考慮到YY0118標準規定了等離子噴涂金屬涂層磨損性能的接受限值,申報產品滿足標準要求即可,一般不再要求與同品種醫療器械進行測試對比。
若申報產品股骨柄和髖臼杯的涂層與注冊申請人境內已上市的髖關節假體相比,基底材料、涂層材料、涂層工藝、及其質控要求均未發生改變,可充分表征申報產品的涂層性能和微觀結構,提供涂層未發生變化的支持性資料,不再需要與同品種醫療器械進行測試對比。
(5)髖臼杯與聚乙烯內襯鎖定性能
髖臼杯和襯墊通常為機械鎖定,需對比申報產品與同品種醫療器械的鎖定性能,包括軸向推出試驗、撬出試驗、旋轉分離試驗等。
若申報產品與注冊申請人境內已上市的髖關節假體產品相比,髖臼杯內襯機械鎖定設計無任何變化,即原材料、結構尺寸、工藝和質控要求完全相同,可提供相應支持性資料,不需與同品種醫療器械進行測試對比。
(6)金屬球頭錐連接性能
若申報產品組件含有錐連接(如球頭與股骨柄、模塊式股骨柄組件間),需提供申報產品與同品種醫療器械錐連接性能的對比資料,如抗拔出性能、抗扭矩性能等。
若申報產品與注冊申請人境內已上市的髖關節假體產品相比,錐連接設計無任何變化,即原材料、結構尺寸、工藝和質控要求完全相同,可提供相應支持性資料,不需與同品種醫療器械進行測試對比。
(7)陶瓷球頭與陶瓷內襯組件性能
陶瓷球頭需與配合使用的股骨部件進行破碎試驗、疲勞試驗、疲勞后破碎試驗、脫出試驗、扭矩試驗,陶瓷內襯需與配合使用的髖臼外杯、股骨部件進行破碎試驗、疲勞試驗、疲勞后破碎試驗、壓出試驗、扭矩試驗和撬出試驗。注冊申請人可將上述試驗結果與同品種醫療器械進行比較,也可根據公認的接受限值論述試驗結果的可接受性。
(8)活動范圍
建議參照YY0118標準提及的方法開展試驗。考慮到相應標準規定了活動范圍的接受限值,申報產品活動范圍滿足標準要求即可,一般不再要求與同品種醫療器械進行測試對比
(9)其他
注冊申請人需選擇各組件最差情形作為測試樣品,最差情況指在性能測試中預期表現最差的規格。結構設計差異顯著,難以論證最差情況的組件建議分別開展測試。
在與同品種醫療器械進行性能對比時,測試方法和參數應相同,注冊申請人應在對比表中列明申報產品與同品種醫療器械的測試方法和結果數據。
若存在相應測試標準,建議采取標準規定的測試方法和參數進行測試,若自行設計測試方法或改變標準中的測試參數,需提供測試方法和參數的合理依據,同時與同品種醫療器械開展測試對比。
(四)論證差異不對安全有效性產生不利影響
1.產品設計和關鍵尺寸
注冊申請人需明確申報產品與同品種醫療器械結構尺寸的相同性和差異性,并論述差異對產品安全有效性的影響。不同的結構尺寸差異對安全有效性的影響不同,評價差異對安全有效性影響的方法亦不相同。
部分結構尺寸差異通過分析可論證其不對安全有效性產生不利影響。例如,近端固定生物型股骨柄在同品種醫療器械基礎上增加了遠端開槽設計,開槽位置位于遠端且長度較小,經過充分分析發現其不影響柄身力學性能,亦不影響股骨柄初始和長期固定穩定性,論證該差異不對申報產品安全有效性產生不利影響。
部分結構尺寸差異需通過力學試驗論證其不對安全有效性產生不利影響。例如,錐連接結構尺寸存在差異,若該差異僅影響股骨柄和球頭連接性能,此時可開展錐連接與球頭連接力學試驗,若結果顯示申報產品不差于同品種醫療器械,則可證明該結構尺寸差異不對申報產品安全有效性產生不利影響。
部分結構尺寸差異需增加具有相似或相同設計的已上市產品作為同品種醫療器械,以論證其不對安全有效性產生不利影響。例如,若申報產品存在與所選同品種醫療器械不同設計型號時,可增加同品種醫療器械以證明該設計型號的安全有效性。
2.材料性能
若申報產品與同品種醫療器械材料牌號不同,建議增加相同牌號材料同品種醫療器械進行測試對比。
3.產品性能
若申報產品性能優于或與同品種醫療器械相當,可為申報產品與同品種醫療器械具有相同的安全有效提供科學證據。若申報產品部分力學性能低于同品種醫療器械,注冊申請人需分析申報產品力學性能較低的原因,可通過對產品進行設計變更以提高產品的力學性能。若注冊申請人降低申報產品部分力學性能,以獲取其他方面的臨床受益,需從臨床風險和受益的角度論述力學性能降低后仍可以接受的充分理由及證據,申報產品臨床數據可為產品臨床風險受益提供證據。
論證涂層微觀結構對體內骨整合效果的影響通常較難,若難以論證微觀結構差異對骨整合的影響,可考慮增加具有相同涂層的同品種醫療器械,或通過動物試驗予以論證。
三、同品種醫療器械的臨床數據
建議優先選擇具有長期臨床安全應用史的產品作為同品種醫療器械。該類產品積累了較多的臨床數據,含有較多公開的臨床數據,如臨床文獻和登記數據庫數據,亦包括較多的中長期臨床數據,其在真實的臨床實踐環境中的安全有效性較為確切。
髖關節假體同品種醫療器械的臨床數據常包括臨床文獻數據、登記數據庫數據、不良事件數據等類型,注冊申請人也可通過同品種醫療器械企業授權獲取臨床試驗數據。鼓勵使用良好治理的各國關節數據登記數據庫中的數據,相較于其他類型數據,該數據具有人群覆蓋面大、隨訪時間長等優勢,可用于評價髖關節假體系統的中遠期安全有效性。登記數據庫數據呈現注意明確不同時間點的累計翻修率及其95%置信區間、假體植入例數、翻修例數、累計觀察年、最短最長觀察年等。
考慮到髖關節假體數據來源的多樣性,建議注冊申請人提取關鍵要素,以圖表形式呈現數據,以附件的形式提供數據來源的原文件和/或原文。
(一)有效性數據
對于髖關節假體,有效性臨床數據可參考以下關鍵要素提取數據:
1.患者信息:性別、年齡、診斷、骨質情況、伴隨疾病以及其他影響臨床結局的特征等;
2.產品信息:產品名稱、型號規格;
3.研究設計:設計類型、樣本量、研究證據等級;
4.評價指標:提取各時間點(包括術前、術后各隨訪點)評價指標數據,包括但不限于生存率或翻修率、功能性評分、活動范圍和生活質量評分等。相關的功能性評分包括Harris評分、Oxford評分、Charnley評分、HHS評分、Merle D’Aubigne評分、VAS評分、SF-36/SF-12評分、HOOS評分、Q-5D評分、牛津評分、WOMAC評分、UCLA活動評分等。
如上所述,髖關節假體產品有效性評價指標種類較多,在收集和分析同品種醫療器械有效性數據時,應分別對各評價指標數據進行匯總分析,適用時開展薈萃分析。
(二)安全性數據
常見的髖關節假體不良事件包括脫位、假體周圍骨折、松動、骨溶解、感染、下肢不等長、大腿疼、粗隆不愈合、活動范圍受限等。髖關節假體安全性數據常來源于各國不良事件數據庫、召回數據庫和臨床文獻,不良事件數據庫包括各國藥監局的不良事件數據庫、企業自身的不良事件數據庫、醫院的不良事件數據庫和第三方商業公司或協會組織運行的不良事件數據庫。針對不良事件,應以表格的形式提供各國上市時間、銷售數量(如可獲取)、不良事件類別及數量、與產品相關性、事件描述、原因分析、處理方式和處理結果等具體信息。
附錄:可參考的指導原則
1 | 《醫療器械臨床評價技術指導原則》(2021年第73號通告) |
2 | 《醫療器械臨床評價等同性論證技術指導原則》(2021年第73號通告) |
3 | 《醫療器械注冊申報臨床評價報告技術指導原則》(2021年第73號通告) |
4 | 《髖關節假體系統注冊技術審查指導原則》(2017年第23號通告) |