醫療器械臨床試驗是指:獲得醫療器械臨床試驗資格的醫療機構對申請注冊的醫療器械在正常使用條件下的安全性和有效性按照規定進行試用或驗證的過程。醫療器械臨床試驗的目的是評價受試產品是否具有預期的安全性和有效性 。
引言:醫療器械臨床試驗是對申辦方申請注冊的醫療器械臨床試用或驗證的過程。那么,醫療器械臨床試驗執行流程是什么?以下是醫療器械臨床試驗的官方介紹。

一、醫療器械臨床試驗定義
在具備相應條件的臨床試驗機構中, 對擬申請注冊的醫療器械在正常使用條件下的安全有效性進行確認的過程。
二、醫療器械臨床試驗前的準備
預期的受益應當大于可能出現的損害。
完成醫療器械臨床前研究。
準備充足的試驗用醫療器械。
醫療器械臨床試驗應當在兩個或兩個以上醫療器械臨床試驗機構中進行。
申辦者與臨床試驗機構和研究者達成書面協議。
列入需進行臨床試驗審批的第三類醫療器械目錄產品的臨床試驗需獲得批準。
申辦者應向所在省、自治區、直轄市食品藥品監督管理部門備案。
三、醫療器械臨床試驗方案
申辦者應按試驗用醫療器械的類別、風險、預期用途等組織制定臨床試驗方案。
臨床試驗方案設計時應先進行小樣本可行性試驗。
臨床試驗方案應包括:
1. 一般信息
2. 臨床試驗的背景資料
3. 試驗目的
4. 試驗設計交
5. 安全性評價方法
6. 有效性評價方法
具體內容詳見《醫療器械臨床試驗質量管理規范》
四、注冊申報需要提交哪些資料?
倫理委員會意見
臨床試驗方案
臨床試驗報告
具體內容詳見《醫療器械臨床評價技術指導原則》
五、醫療器械臨床試驗審批
1. 臨床試驗審批定義
對人體具有較高風險的第三類醫療器械進行臨床試驗應獲得國務院藥品監督管理部門批準。
2. 需進行臨床試驗審批的第三類醫療器械目錄
國家食品藥品監督管理總局關于發布需進行臨床試驗審批的第三類醫療器械目錄的通告(2014年第14號)
3. 臨床試驗審批流程
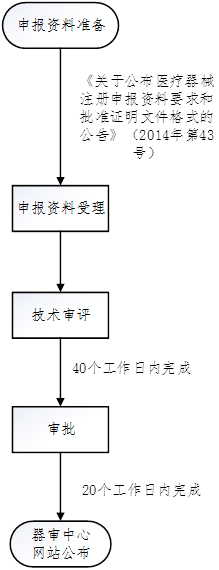
六、TIPS
臨床試驗審批改為默許制:自臨床試驗審批申請受理并繳費之日起60個工作日內,申請人在預留聯系方式、郵寄地址有效的前提下,未收到器審中心意見(包括專家咨詢會議通知和補充資料通知)的,可以開展臨床試驗。
多中心臨床試驗需按照統一試驗方案在不同臨床試驗機構中同期進行
相關法規
關于調整醫療器械臨床試驗審批程序的公告(2019年 第26號)
關于公布醫療器械注冊申報資料要求和批準證明文件格式的公告(2014年第43號)
醫療器械臨床試驗質量管理規范(國家食品藥品監督管理總局 中華人民共和國國家衛生和計劃生育委員會令第25號)
醫療器械臨床評價技術指導原則(2015年第14號)
醫療器械臨床試驗設計指導原則(2018年第6號)
國家食品藥品監督管理總局關于發布需進行臨床試驗審批的第三類醫療器械目錄的通告(2014年第14號)
無源植入性醫療器械臨床試驗審批申報資料編寫指導原則(2018年第40號)
總局關于需審批的醫療器械臨床試驗申請溝通交流有關事項的通告(2017年第184號)
第三類高風險醫療器械臨床試驗審批服務指南