為進一步規范椎間融合器產品管理,為醫療器械注冊人和醫療器械注冊?審評提供指導,國家藥監局發布了《椎間融合器注冊審查指導原則(2024年修訂版)》,接著修訂版文件發布這個機會,帶大家一起了解椎間融合器產品技術要求及注冊審查要點。
引言:為進一步規范椎間融合器產品管理,為醫療器械注冊人和醫療器械注冊審評提供指導,國家藥監局發布了《椎間融合器注冊審查指導原則(2024年修訂版)》,接著修訂版文件發布這個機會,帶大家一起了解椎間融合器產品技術要求及注冊審查要點。
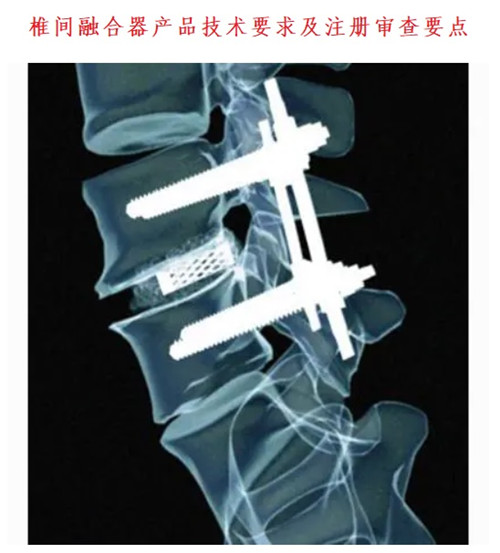
一、椎間融合器產品技術要求
椎間融合器產品技術要求的制定需符合《醫療器械產品技術要求編寫指導原則》的要求,同時結合產品具體適用的指導原則或相關國家標準、行業標準以及產品的特點,選擇適用項對各項性能指標和檢驗方法進行制定,以保證產品安全、有效、質量可控。
3.1產品型號/規格及其劃分說明
提供產品規格型號、結構組成示意圖,列明制造材料等內容。
3.2性能指標
產品技術要求中指標需針對終產品,選取適用的項目制定,且性能指標不低于產品適用的強制性國家標準和/或強制性行業標準。
3.2.1外觀
3.2.2表面缺陷
3.2.3表面粗糙度(多孔結構不適用),如帶涂層,需明確涂層表面粗糙度。
3.2.4關鍵尺寸及公差
3.2.5涂層表面形貌(如適用,需明確厚度、孔隙率、平均孔隙截距)
3.2.6涂層靜態力學性能(如適用,包括涂層和基體間的拉伸強度和剪切強度)
3.2.7配合性能(如適用,單個組件申報時不適用)
3.2.8壓縮剛度(頸椎、胸腰椎需分別制定)
3.2.9無菌(如適用)
3.2.10環氧乙烷殘留量(如適用)
3.3檢驗方法
產品的檢驗方法需根據技術性能指標設定,優先采用公認的或已頒布的國家標準、行業標準檢驗方法,包括推薦性標準,需注明相應標準的編號和年代號。自建檢驗方法需提供相應的方法學依據及理論基礎,同時保證檢驗方法具有可操作性和可重現性,必要時可附相應圖示進行說明,文本較大的可以附錄形式提供。
3.4附錄
在附錄中可更為詳盡地注明產品某些描述性特性內容,如金屬材料的化學成分、顯微組織、內部質量、力學性能;聚醚醚酮材料的理化性能(如紅外光譜、黏度);羥基磷灰石涂層,明確材料的鈣磷原子比、結晶相含量、微量元素含量;同時明確產品材料性能符合標準;表面經陽極氧化工藝處理產品,還需明確陽極氧化表面元素殘留的要求;射線可探測性等要求。
3.5其他
如有不適用的項目,需予以說明。本部分僅提供了常規產品的基本性能要求,給予參考。
對于使用新材料、新技術、新設計或具有新作用機理、新功能的產品,需在產品技術要求中明確產品所具的有其他功能性、安全性指標。
4.產品檢驗
注冊申請人需提供符合醫療器械注冊申報法規文件要求的檢驗報告。若申報的產品包括多個型號,選取檢驗的典型性型號需能代表本注冊單元內其他產品的安全性和有效性。
二、椎間融合器注冊審查要點
1.產品名稱
產品的命名需采用《醫療器械分類目錄》或國家標準、行業標準中的通用名稱,或以產品結構及組成、臨床預期用途、適用部位為依據命名,需符合《醫療器械通用名稱命名規則》《無源植入器械通用名稱命名指導原則》等相關法規的要求,可增加表述產品材料、特殊工藝或特殊設計等特征詞,例如純鈦涂層椎間融合器、自穩定型頸椎融合器、激光選區熔融鈦合金椎間融合器、頸椎前路椎間融合器等。
2.分類編碼
根據《醫療器械分類目錄》,分類編碼為13-03-04,管理類別為Ⅲ類。
3.醫療器械注冊單元劃分
產品注冊單元的劃分需符合《醫療器械注冊單元劃分指導原則》的要求。椎間融合器臨床預期用途較為統一,頸椎、胸腰椎產品可作為同一注冊單元,不考慮微創、開放、前路、后路等術式區別。
材料不同的同類組件需劃分為不同注冊單元。作為單一整體組配或組合使用、材質已確定且唯一的組件,如自穩定型椎間融合器的固定板(鈦合金)、主體(聚醚醚酮)及螺釘(鈦合金),雖組件間材質不同,但因組合使用,可作為同一注冊單元申報。有涂層和無涂層產品應劃分為不同的注冊單元,有涂層時,涂層材料差異亦需考慮,不同涂層材質的椎間融合器作為不同的注冊單元申報。不同結構設計或不同工作原理的椎間融合器原則上需考慮劃分為不同注冊單元,如自穩定型椎間融合器和配合脊柱內固定系統使用的椎間融合器宜考慮劃分為不同注冊單元。
主要制造工藝方法不同,如增材制造與機加工、不同增材制造、不同涂層工藝等,需劃分為不同注冊單元。(二)綜述資料
1.產品描述
1.1明確產品的結構及組成,包括但不限于所含組件(如自穩定型椎間融合器包括主體、固定板和螺釘),選用材料及符合標準(如適用),材料牌號信息,交付狀態,滅菌方式,產品有效期信息。
1.2明確產品的通用名稱及其確定依據;明確產品的管理類別,包括:所屬分類子目錄名稱、一級產品類別、二級產品類別,管理類別,分類編碼;明確產品的適用范圍;明確產品的背景信息概述或特別細節,如:申報產品的歷史概述、境內外上市情形、前代產品的概述(如有)、歷次注冊申報情況,與其他經批準上市產品的關系等,如不適用,應說明。
1.3產品結構設計描述一般包括產品各型號規格、各組件、各關鍵部位的結構圖和幾何尺寸參數(包括允差)。
結構圖應以產品設計工程圖為藍本,從整體外觀、局部細節放大圖等明確產品的設計特征,必要時應提交臨床使用時的解剖適配圖。明確固定板、螺釘的數量、螺紋設計、鎖定結構(若有),帶涂層產品涂層分布情況,顯影區的邊界及在融合器中位置。
幾何尺寸參數主要包括主體的長、寬、高,植骨區尺寸(包括壁厚)、橫向開孔尺寸,終板接觸面的弧度、傾角,咬合齒的高度、齒形,螺釘直徑,固定板孔徑等,不適用項目需進行說明。
帶涂層椎間融合器,建議參考YY/T 0988.14中的體視法明確其涂層厚度、孔隙率、平均截距等涂層表征參數;增材制造多孔椎間融合器,還應包括形貌、絲徑、最小打印單元結構、孔隙率、孔徑、孔隙漸變梯度、內部連通性,多孔結構的厚度(如致密區域、多孔區域的分布),內外部加強柱設計等,部分項目在特定情形下可能不適用。
2.型號規格
對于存在多種型號規格的產品,需根據產品結構設計描述明確各型號規格的區別,可采用對比表及帶有說明性文字的圖片(如提供椎間融合器固定在脊柱模型上的放大照片和/或實物圖)、圖表,對各種型號規格的結構組成、關鍵幾何尺寸、產品特征、性能指標、功能等方面加以描述。
3.包裝說明
需以圖片和文字相結合的方式明示申報產品的包裝信息,包括包裝材料的信息,并以列表形式說明所有包裝內容物。
4.與同類和/或前代產品的參考和比較
需提供同類產品(國內或國外已上市)或前代產品(如有)的信息,闡述申請注冊產品的研發背景和目的。對于同類產品,需說明選擇其作為研發參考的原因。
需綜述同類產品國內外研究、臨床使用現狀及發展趨勢。同時列表比較說明申報產品與參考產品(同類產品或前代產品)在材料、結構設計、適用范圍及產品性能指標等方面的異同。明確產品有無使用了新材料、新技術、新設計或具有新作用機理、新功能。
5.適用范圍和禁忌證
產品的適用范圍、適用人群、禁忌證需與申報產品的性能、功能相符。
5.1適用范圍
適用范圍的表述需客觀、清晰,使用有明確定義或行業公認的術語或名詞。如與脊柱后路內固定系統配合使用,適用于頸椎、胸腰椎節段(明確具體節段范圍)的椎間融合術。
5.2預期使用環境
明確預期使用的地點(如醫療機構),說明可能影響其安全性和有效性的環境條件。
5.3適用人群
說明該器械目標患者人群信息,提供患者選擇標準的信息以及使用過程中需要監測的參數、考慮的因素、不適宜應用的某些疾病、情況或特定人群(如適用)。
5.4禁忌證
如適用,通過風險/受益評估后,針對某些疾病、情況或特定的人群,認為不推薦使用該產品,需明確說明。
6.申報產品上市歷史
如適用,提交申報產品在各國家或地區的上市批準時間、銷售情況。如有不良事件和召回,分別對申報產品上市后發生的不良事件、召回的發生時間、申請人采取的處理和解決方案、相關部門的調查處理情況等進行描述。